Community
osapeers.org
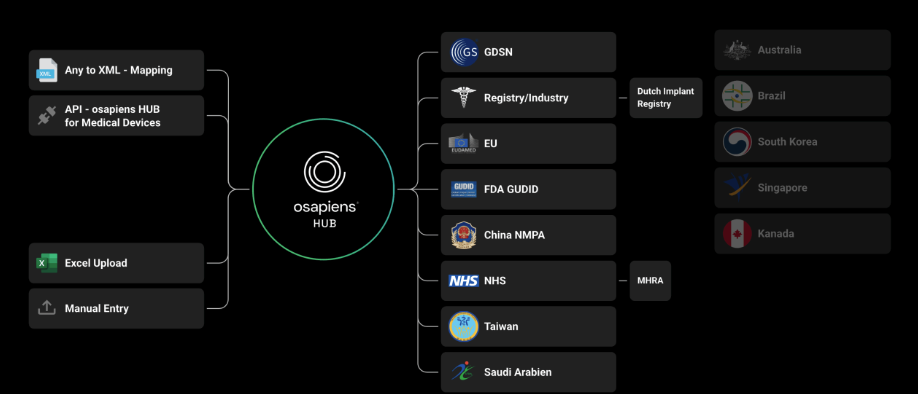
Para los fabricantes de dispositivos médicos, contar con datos de producto completos y precisos es esencial para cumplir tanto con los requisitos normativos como con los de los socios comerciales. Reglamentos como EUDAMED (Comisión Europea) y GUDID (FDA de EE. UU.) exigen el envío de información de producto detallada a sus respectivas bases de datos antes de que los productos puedan comercializarse. Estos datos constituyen la base de una cadena de suministro sanitario segura y protegida, lo que permite una supervisión poscomercialización más fiable y mejora significativamente la seguridad del paciente.
La plataforma de osapiens respalda los requisitos normativos, incluidos EUDAMED, GUDID, SFDA (Arabia Saudí), TFDA (Taiwán) y el registro LIR de Países Bajos (vía GDSN), así como futuros requisitos de TGA Australia, Swissmedic, Emirates Health Services (EHS) y Dubai Health Authority (DHA).
Al automatizar el intercambio de datos, osapiens reduce el esfuerzo manual en todo el ciclo de vida del producto, agiliza el cumplimiento normativo y mejora la eficiencia operativa.