Comment osapiens accompagne le secteur des dispositifs médicaux
Pour les fabricants de dispositifs médicaux, disposer de données produits complètes et précises est indispensable pour satisfaire aux exigences réglementaires et commerciales de leurs partenaires. Des réglementations telles qu’EUDAMED (Commission européenne) et GUDID (FDA américaine) imposent la soumission d’informations détaillées dans leurs bases de données respectives avant toute mise sur le marché. Ces données sont la clé d’une chaîne d’approvisionnement plus sûre et plus transparente dans le secteur de la santé, favorisant une surveillance post-commercialisation efficace et contribuant à renforcer la sécurité des patients.
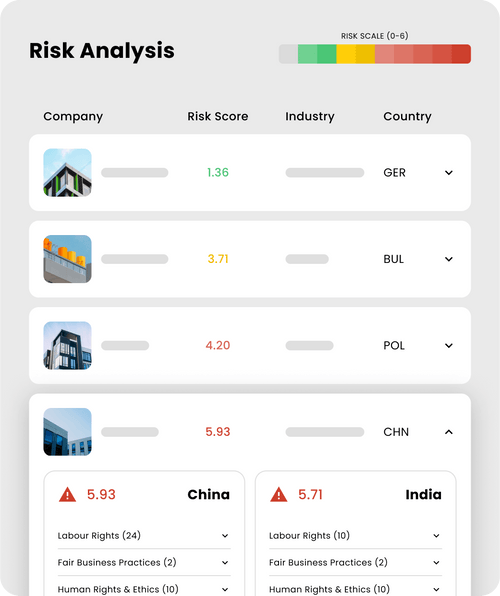
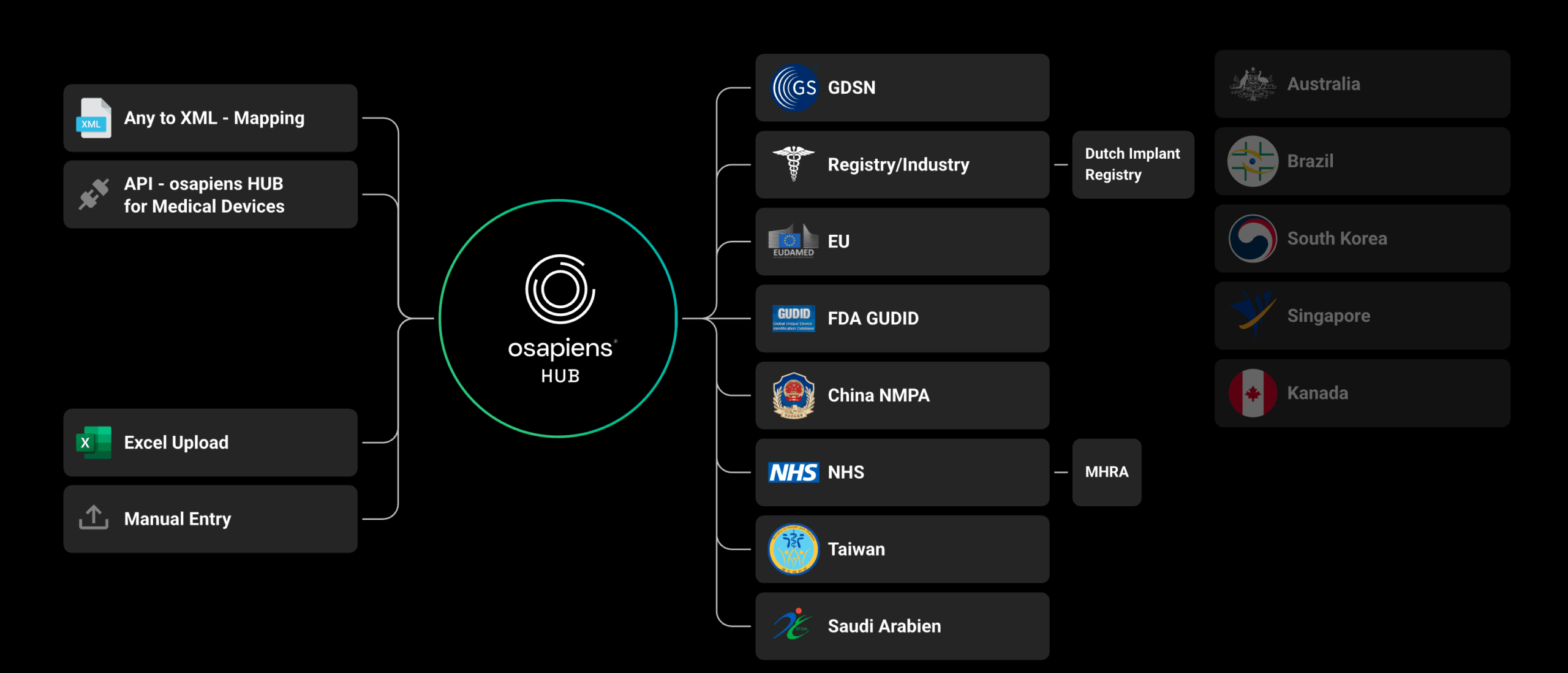
La plateforme osapiens prend en charge l’ensemble des exigences réglementaires en vigueur, notamment celles d’EUDAMED, du GUDID, de la SFDA (Saudi-DI), de la TFDA (Taïwan) et du LIR néerlandais (via GDSN), ainsi que les futures réglementations de la TGA (Australie), de Swissmedic, des Emirates Health Services (EHS) et de la Dubai Health Authority (DHA).
En automatisant l’échange de données, osapiens réduit les tâches manuelles à chaque étape du cycle de vie du produit, simplifie la mise en conformité et accroît l’efficacité opérationnelle.
Solutions pour la transparence
osapiens for Medical Devices
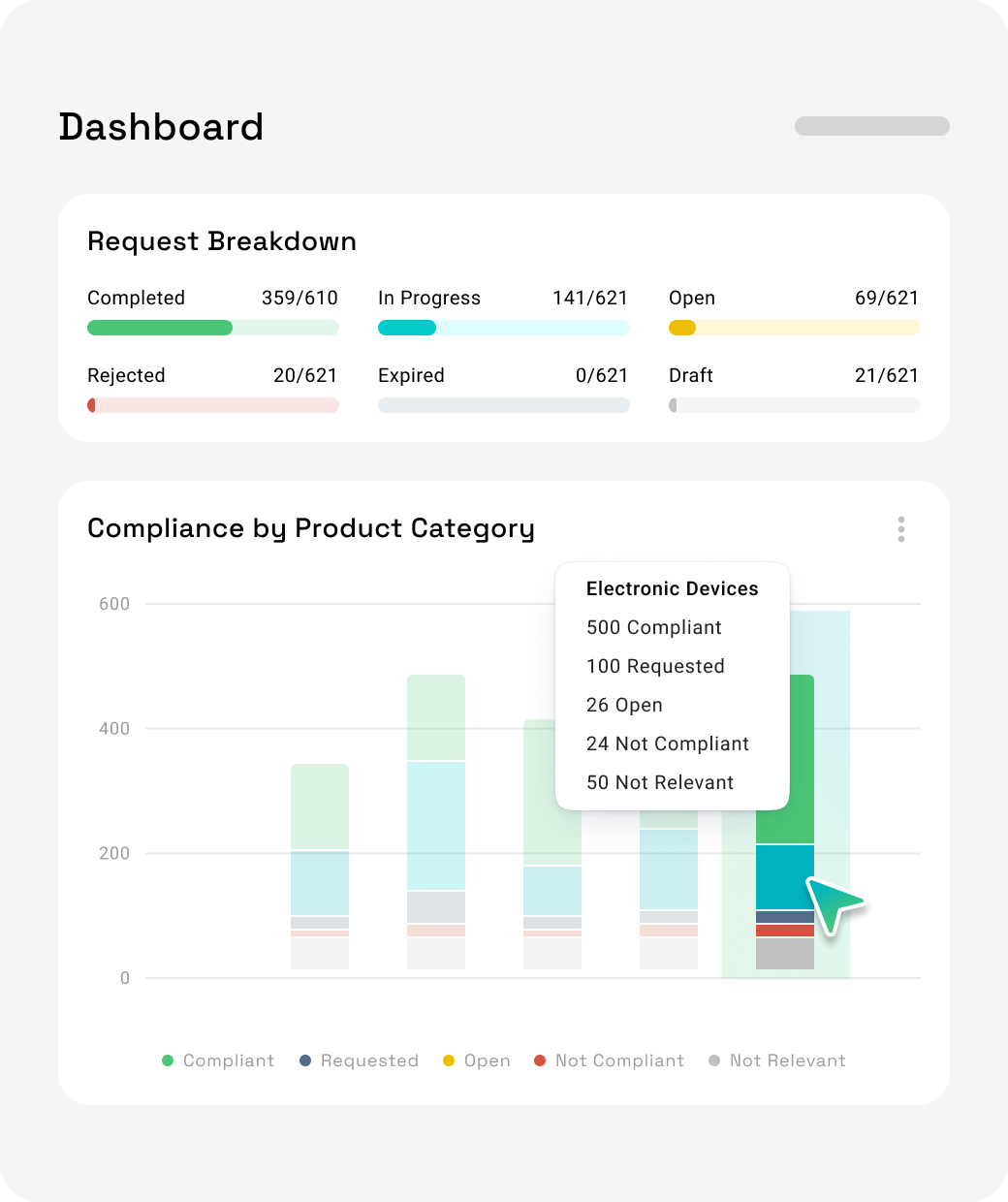
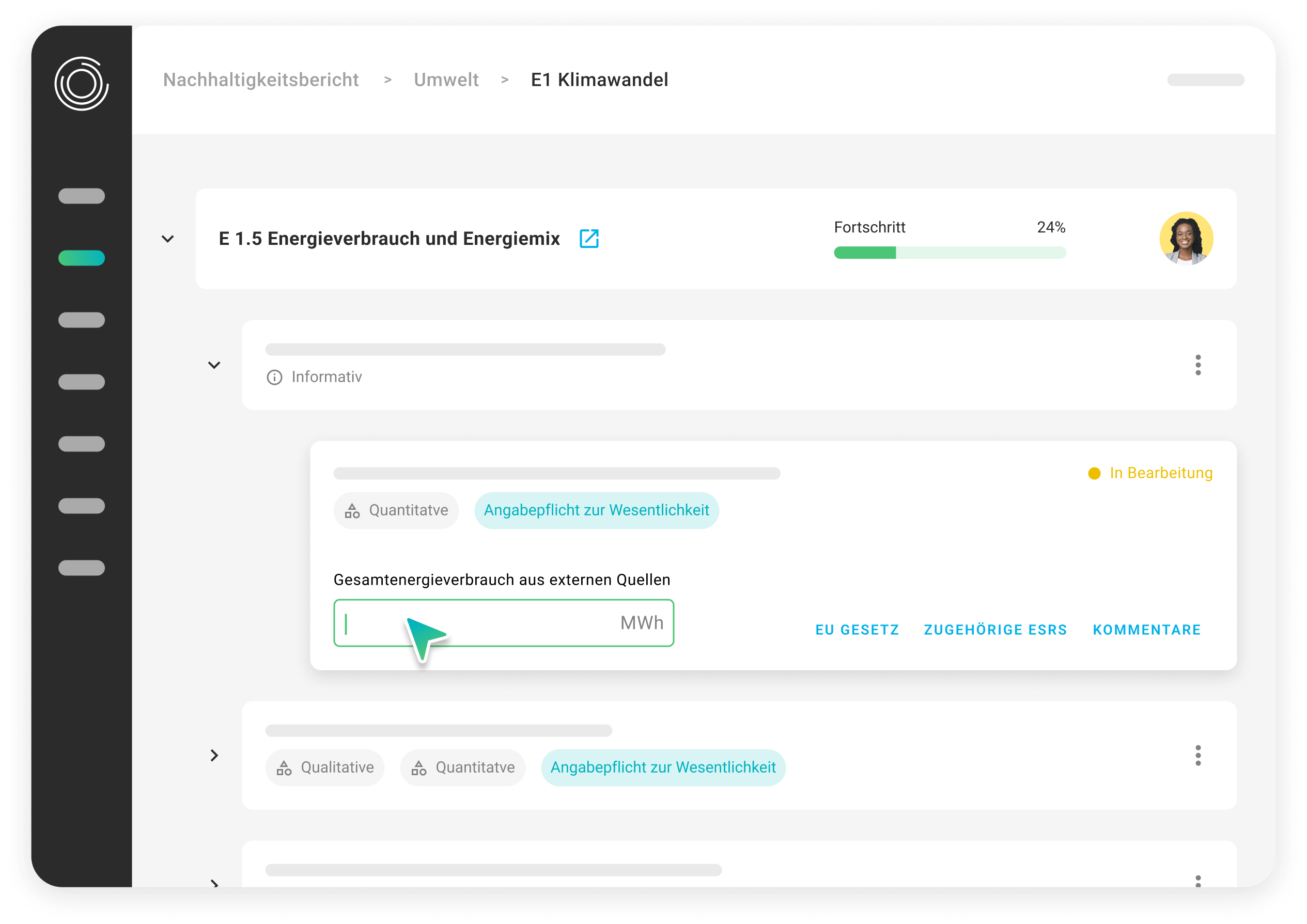
Gestion des données réglementaires
Échangez des données produits avec des systèmes comme EUDAMED, GUDID et LIR via des formats validés et structurés. La plateforme est conforme aux exigences UDI et s’adapte aux normes régionales.
Efficiency Solutions pour une efficacité accrue
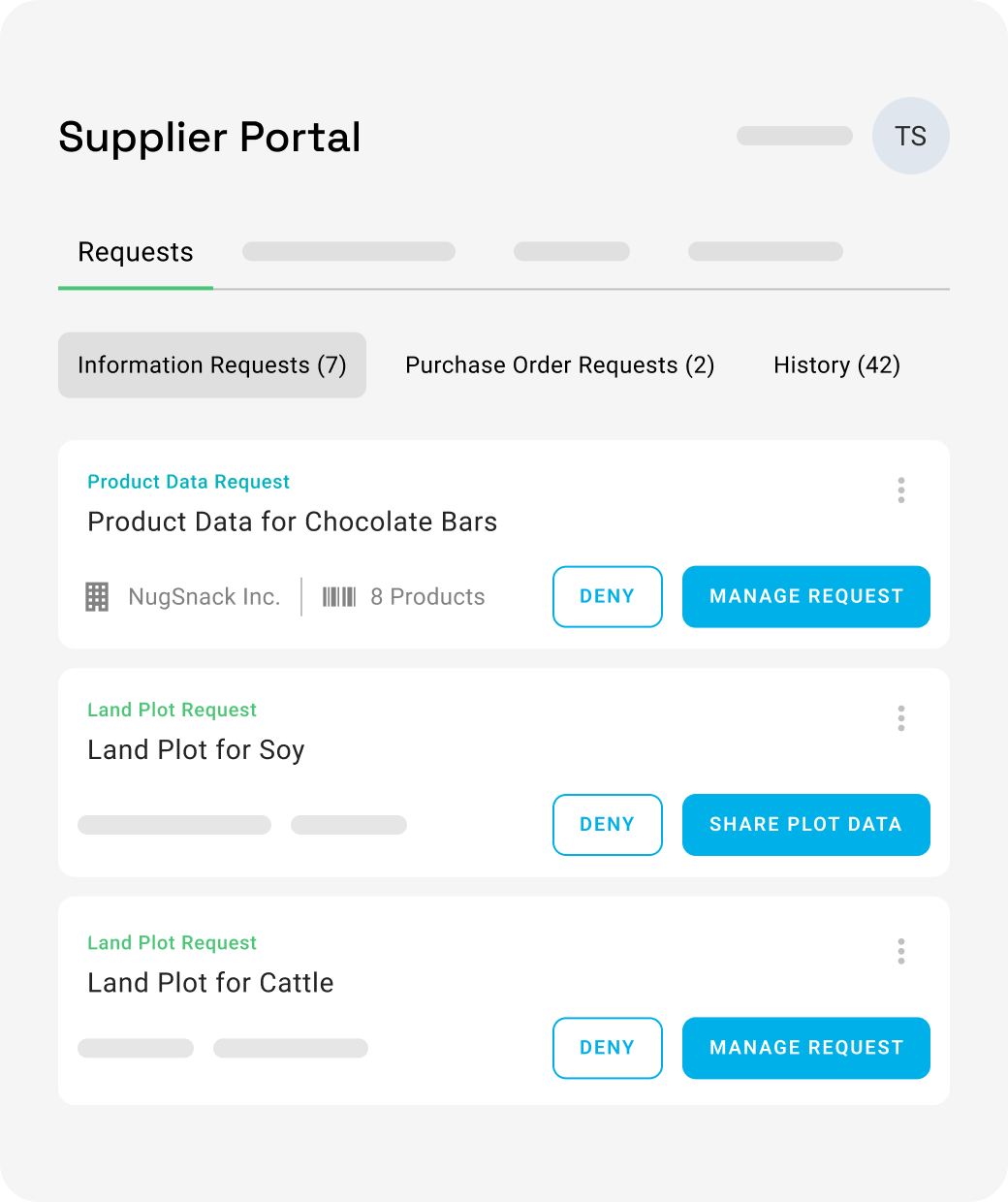
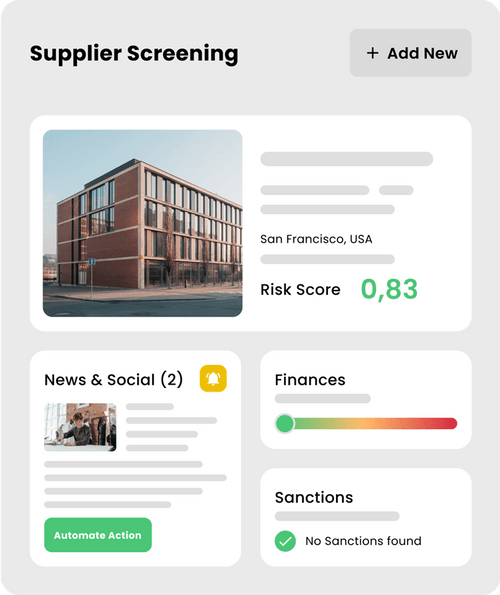
osapiens HUB for Supplier Relationship Management
Optimisez la collaboration et la performance fournisseurs